臨床試験登録の必要性
臨床試験の登録が必要な理由は、一般的には、大きく次の3点で説明されます。
1.科学的論拠-出版バイアスの防止
新しい治療法や手法が従前のものに比して優れていることを示す結果(ポジティブな結果)が得られた場合と、
有意に優れていなかったり期待に反していたりすることを示す結果(ネガティブな結果)が得られた場合とでは、前者の場合に、
より結果が公表されやすいことが知られており、それを「出版バイアス」と言います。これは、一般的に、世の中の関心がポジティブな
結果に集中しがちであることに原因があります。雑誌編集者はネガティブな結果を雑誌に掲載しようとする動機が弱くなり、研究者も、期待に
反した結果であると、論文化に消極的になることがあるためです。
出版バイアスの弊害として、次のようなことが考えられます。ある治療法についてのより真実に近い有効性を示すことを
目的に、関連する複数の試験結果を統合して解析することがあります。このような統合的解析の対象となる試験は、公表 されたものが当然多くなります。
ネガティブな結果は公表されているものが少ないですから、ネガティブな結果が公正に 解析に統合されず、その治療法の有効性が過大評価されてしまう
可能性があります。ここで、研究者がポジティブな結果 だけを意図的に公表すると、研究者にとって都合のよい結論が誘導できてしまうことになります。
また、無効な治療法が 公表されないために、実施する意義のない試験が繰り返されることは、研究資源の浪費とも言えます。
ある試験を登録することで、その試験をスタートとしての試験登録から、結果公表というゴールまでたどり着いているか を確認することができ、
出版バイアスの存在の可能性を知る手掛かりとなります。出版バイアスが疑われる場合には、関連する試験結果の見方が変わってくるとことが考えられます。
2.倫理的義務
医学研究に携わる者の倫理指針を示すヘルシンキ宣言において、ポジティブな結果、ネガティブな結果とも広く利用可能 な方法で公表しな
ければならないという条文があります。試験結果が世の中に還元され、活用されることを願っている試験 参加者への倫理的配慮からも、ネガティブな場合を含む結果の
公正な公開が求められています。
実施する意義のない試験が繰り返されることは、上述したように研究資源の浪費ばかりでなく、参加者に不利益をもたらす ことにもなりかねず、
研究実施における倫理にも関連する問題です。
3.臨床試験参加者募集の促進
歴史的には、臨床試験登録が必要な理由として最も早く提唱されたものです。約30年前に提唱されました。癌のより優れた 治療法を、
より早く世の中に送り出すことを目的に、米国内でどのような臨床試験が実施されているかをリストアップし、広く 医師や患者に公開することから始まりました。
臨床試験の実施に関する情報を公開することで、被験者登録が促進され、その分 、結果が早く得られることを期待して提唱されたものです。この考え方は、現在でも
通じるものであり、癌に限らず、致死的な 疾患や患者数の少ない疾患の治療法の開発を促進する重要な手段と考えられています。
臨床試験登録システムの現状
1.海外の状況
臨床試験の登録を受け付けている登録システムは、海外には数多く存在しています。これらのシステムを運営する 機関は、政府、製薬や
出版関連の営利企業、学術団体など様々であり、そのため登録情報の利用目的や登録対象とする 臨床試験の種類、登録に必要としている情報、運営の方針なども
それぞれに異なっています。
2.日本の状況
海外における上記のような状況の中、日本国内には臨床試験を登録するシステムがこれまで存在していませんでした。
2004年9月の医学雑誌編集者国際委員会 (International Committee of Medical Journal Editors:ICMJE)および
British Medical Journal (BMJ)の声明を読まれた
複数の研究者からご意見を 頂いたことに端を発して、UMINでは、臨床試験登録の 問題に強い関心をお持ちの研究者によるワーキンググループを立ち上げました。
UMINのサービスの一環として臨床試験 登録システムを運営することについて、2004年10月22日の第1回会合より継続して検討を重ねてきました。
(1)多くの 研究者の方に関連し、広く使っていただけるシステムと考えられること
(2)ICMJEおよびBMJの声明において、臨床試験 登録システムは公的機関が運営し、少なくとも情報は無料で閲覧できるという条件が示されていること
上記などから、臨床 試験登録システムの運営はUMINの特性に合致し、UMINとして積極的に提供すべきサービスであるとの結論に至りました。 ワーキンググループでは、
UMIN-CTRに求められるポリシーから基本的な仕様に至るまで、幅広く検討しました。この 検討結果を基に、2005年2月2日に「UMIN 臨床試験登録システムシンポジウム」を
開催し、UMIN-CTRの概要をご紹介しま した。そこで頂いたご意見や、その後パブリックコメントとして頂いたご意見を参考に、試用版の提供を経て、2005年6月 1日より
本稼動を開始しました。UMIN-CTRは、日本における最初の臨床試験登録システムです。
ところで、すでに海外に多くの臨床試験登録システムが存在する中で、日本においてこれからシステムを立ち上げる ことの意義がどこにある
のでしょうか。臨床試験登録制度は世界的な動きであり、海外の研究者、医療関連の行政機関 、医学雑誌編集者なども日本の臨床試験に対して関心を持つであろうことから、
包括的に情報が取り出せる必要性を考える と、日本で運営するシステムであっても基本言語は英語にならざるを得ないと考えています。しかし、国内を振り返って 見ると、
臨床試験登録システムの一方の大切な利用者である日本人の患者さんや一般の方々が、日本語で情報が取り出せる ことも必要です。したがって、日本において日本語も扱える
臨床試験登録システムの存在は、重要です。また、上述の ように、海外にすでに存在する臨床試験登録システムは、受付ける臨床試験の種類が限定されているものも多く、登録
する際に、自分の臨床試験の登録が受付けてもらえるのかの確認が必要です。しかし、UMIN-CTRでは、臨床試験の種類や 対象疾患を限定することなく受付けますので、上記のよ
うな確認は不要となります。
なお、2005年7月1日より、財団法人 日本医薬情報センター(JAPIC)は、主に製薬企業の実施する臨床試験を対象に臨床試験登録システム(JapicCTI)を
稼動させています。また、日本医師会は、2006年より、主に医師主導型治験を対象に臨床試験登録サイトを立ち上げています。
また、2008年に上記3機関の情報を集約し、Japan Primary Registries Network (JPRN)がWHOのPrimary Registryとして認証され、
2018年にはjRCTが加わり、JPRNがWHOの再認証を受けます。(JAPIC/JMACCTは2023年よりjRCTへ統合されます)
その上で2021年jRCTがWHOのPrimary RegistryとなりポータルサイトはjRCTの中の臨床試験検索サイトに位置付けられました。
現在、日本の臨床試験登録システムは以下の構図となり、jRCTかUMIN-CTRで登録した試験情報が公開されます。
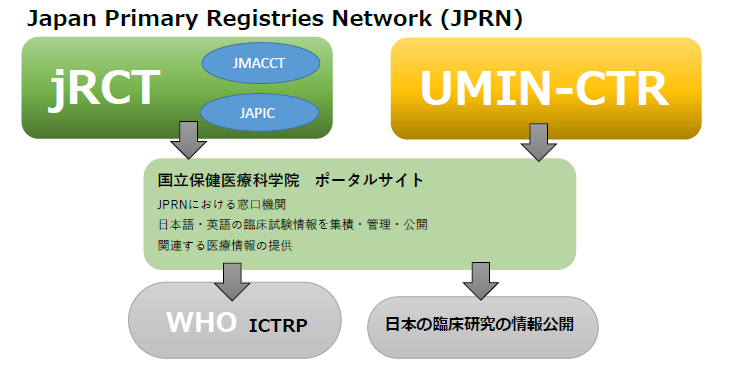
臨床試験登録の現状
臨床試験の登録は、その必要性が提唱されて30年余りが経過し、様々な組織が様々な努力、工夫をしているにも関わら ず、なかなか臨床試験登録に関する議論は盛り上がらず、
実効性がなかったのが実情です。しかし、欧米を中心として実施された、 抗うつ薬の小児および若年者を対象とした2試験で、有意な有効性が示せなかった結果が開示されていなかった
事実が、2004年に 発覚したことが契機となり、広い範囲の関係者を巻き込んだ広がりのある議論に展開しています。
1.医学雑誌の動き
2004年秋、The Lancet、Journal of American Medical Association (JAMA)などが加盟する医学雑誌編集者国際委員会
(International Committee of Medical Journal Editors; ICMJE)と
British Medical Journal (BMJ)が、臨床試験結果の論文の 掲載に、その試験が、ある条件を満たした
登録機関にあらかじめ登録されていることを必要条件とすることを表明しました。これは、臨床試験の登録の必要性に基づいて、これを実効性のあるものにしていくことを
狙ったものです。ICMJEの声明の主旨は次の通りです。BMJの声明の内容は、ICMJEよりも比較的緩い内容となっています。
・登録対象とする試験 (上記が適用される試験):
介入を伴う前向きの臨床試験であって、検証的なものである(探索的な試験は除外する)。
・登録の期限:
2005年7月1日以降に始まる試験では、最初の参加者の組み入れまで。
2005年6月30日までに始まった試験では、2005年9月13日。
・ICMJEが認める登録機関/システムの条件:
無料で一般に公開されること、非営利組織が運営していること、登録しようとする者に公開されていること、登録されたデータを保証する仕組みがあること、電子的にデータが検索できること、次に示す情報を含んでいること
・公開されるべき情報:
試験に対するユニークな識別番号、介入と対照の内容、仮説、主要アウトカム評価項目、副次アウトカム評価項目、適格基準、 臨床試験の登録日、試験開始日(予定または実際)、
最終フォロー日(予定または実際)、データ入力終了日(予定または実際)、データが完成した日付、目標参加者数、研究費提供元、責任研究者の連絡先。
これら12雑誌は、世界的にも有力なものであり、他の医学雑誌の見解に与える影響も大きく、追随する雑誌が出てくると考えられます。
2005年1月から5月にかけて、"Archives of Dermatology"と"American Heart Association journals"の5誌、腎疾患、透析および移植関連の雑誌6誌が臨床試験登録に関して、
ICMJEに同調する旨、または同様のポリシーを表明しました。
2005年5月、ICMJEとBMJは、WHO(世界保健機関)の世界的臨床試験登録制度確立の動きを評価し、2年程度その推移を見守ると発表しました。ICMJEは、さらに、WHOが利害関係者に図って調整した20項目を公開されるべき情報として採用するとしました
(項目の詳細は、下記WHOの項の「登録する情報 (Trial Characteristics ;Minimum data set)」を参照ください)。
2.オタワ声明
オタワ声明は、オタワグループが2005年4月にBMJに発表した、臨床試験の登録と公開に関する国際的原則を確立することを目的とした声明です。
これは、2004年10月のコクラン・コロキウムの一環として開催された会議での討議内容を基に検討を重ね、声明としたものです。オタワ声明に対して公式に支持を表明している組織、個人の総称がオタワグループです。臨床試験登録をしなければならない理由として、試験の参加者、また一般市民に対する倫理的義務を果たすために、臨床試験で得られた情報を還元することを第一に掲げていることが特徴です。オタワ声明の主旨は次のとおりです。
・登録対象とする試験:
ひとつまたはそれ以上の健康に関する介入を参加者に割付け、その効果を評価する前向き研究であって、対照があるかないかは 問わない。研究のトピック、デザイン、アウトカム、
市販されているかどうかに関係ない。
・登録の期限:
試験計画書がある程度固まった時点で臨床試験に対するID番号を取得し、同意書を含むすべての試験関連文書に明記する。その後、 最終的な試験計画書が完成した時点で、必要最低限情報を登録システムに登録し、公開する。
必要最低限の情報の公開の期限は、 参加者組み入れの前。
・登録機関/システムの条件:
無料で一般に公開されること、登録情報の更新内容が公開されること、遅くとも解析が終了する前にはIRBで承認された試験実施 計画所本体、データ収集のための記録用紙が公開されること
・公開されるべき必要最低限の情報:
試験の方法や解析を十分に評価することができる項目。また、IRBで承認された試験実施計画書本体、データ収集のための記録 用紙も公開する。
・結果の公開:
試験実施計画書に規定した解析が終了し、内容の確認がとれた時点で、その内容を公開する。
3.製薬企業の動き
・登録対象とする試験:
探索的研究を除いた試験
・登録の期限:
参加者割付の21日後まで
・登録システムの条件:
一般からアクセスできること
・登録する情報:
簡略的な試験名、試験に関する平易な説明、試験の相、試験のタイプ、試験の進捗状況、試験の目的(治療・診断・予防)、介入の種類(医薬品・ワクチン など)、
対象疾患、主要な適格基準、試験実施地域と問い合わせ先
試験実施計画書を、一般からはアクセスできないデータベースに登録する。
・結果の公開:
承認を受けた医薬品の、探索的試験を除いた試験の結果を、一般からアクセスできるデータベースに公開すべきである。ただし、開発を中止した医薬品において、医学的に重要 (Medically significant)と考えられる結果は、
可能であればデータベース上で公開することを推奨する。
4.WHO(世界保健機関)の動き
世界保健機関(WHO)は、2003年10月、健康問題の解決における科学的情報の共有(特に、発展途上国との共有)を強調し、
それ以来、臨床試験の登録と公開の問題をWHOとして取り組むべき課題として掲げています。WHOは、国際的に中立な立場である ことから、その適切な調整役を自負し、
臨床試験登録を制度として定着させるべく、
国際的臨床試験登録プラットフォーム (International Clinical Trials Registry Platform: ICTRP)プロジェクトを立ち上げました。この問題の利害関係者である 、研究者、研究支援団体、医学雑誌、主要な登録システム運営機関、各国の保健関連省庁、主要な多国籍製薬企業や製薬工業 団体などに呼びかけて、この議論の調整に乗り出しています。
2004年4月に、利害関係者を一同に招いた会議(ニューヨーク会議)を開催し、「ニューヨーク宣言」が発表されました。 「ニューヨーク宣言」におけるポイントは、国際的、包括的に臨床試験の情報を取り出せる必要性と、臨床試験に対する統一的な 識別子の付与の必要性が確認されたことです。2004年11月に開かれたメキシコでのMinisterial Summit on Health Researchでも 問題提起し、宣言文で ICTRPの考え方を提示しました。
2005年4月には、ニューヨーク宣言をより具体的にし、ICTRPプロジェクトを推進していくための具体的指針を確立するために、 WHO technical consultation on clinical trial registration standards meetingを開催しました。この会議では、利害関係者の 参加の下、次の4点について話し合われました。おおむね、以下にまとめられる合意が得られました。しかし、細かい点においては、 さらに検討の必要性が残っている部分があります。
合意が得られた点は、WHOのICTRPプロジェクトサイトにレポート(ドラフト)として掲載されています。
臨床試験登録の標準(登録対象とする試験と登録の期限;Registration Standards (Which trials to register / When to register a trial?)
登録対象とする試験は、ヒトまたはヒトのグループを、ひとつまたはそれ以上の健康に関する介入を行う群に前向きに割付け、 その効果を評価するために行うすべての研究。登録の期限は、可能な限り早くであり、最初の参加者の登録・組み入れ前が理想的。 同意説明文書など、関連する書類に臨床試験に対するID番号が明記されるべき。
登録する情報 (Trial Characteristics ;Minimum data set)
試験に対するユニークな識別番号 (Unique trial number)、試験に対するその他の識別記号 (Secondary IDs)、試験の簡略名 (Title of the study (Brief title))、試験の正式名 (Official scientific title of the study)、対照疾患 (Condition)、 介入と対照の内容 (Intervention(s))、主要アウトカム評価項目 (Primary outcome)、副次アウトカム評価項目 (Key secondary outcome)、主要な適格基準 (Key inclusion and exclusion criteria)、
試験のタイプ (Study type)、臨床試験の登録日(Trial registration date)、試験開始予定日 (Anticipated trial start date)、目標参加者数 (Target sample size)、倫理委員会に よる承認の有無 (Research ethics review)、研究費提供元 (Funding source(s))、主要な試験実施責任組織 (Primary sponsor)、 共同実施組織 )Secondary sponsor(s))、試験の問い合わせ先 (Responsible contact person)、責任研究者の連絡先 (Research contact person)、進捗状況 (Recruitment status)
結果の公開(Results disclosure)
一般的に、臨床試験の結果は、試験終了後1年以内に結果データベースに公表されるべき。新しく開発された医薬品については、 最初の製剤の市販開始から1年以内とし、その後に実施された試験については、試験終了後1年以内。結果として公表すべき内容は、 ICH-E3の要約用の雛形を利用する。
登録機関/システムの条件とWHOの役割(Where to register and WHO role)
"Minimum data set"が一般に公開されること、インターネット経由で電子的に検索できること、登録費用は無料または登録の障害と ならない必要最小限の費用でおこなえること、登録する者に情報の正確さの責任がある、登録が標準的手順書によって行われること、 試験に対するユニークなID番号が付与されること、情報の更新がおこなわれるかどうかを明確にしていること、運営機関が営利、 非営利かは問わない、登録情報の長期的存続が可能であること。(WHOの役割については、特に提言なし)
WHOは、2006年内にWHO主導の世界的臨床試験登録制度を始めようとしています。WHOは、この制度の中で、独自に臨床試験登録システムを立ち上げることはせず、世界に既に存在する臨床試験登録システムを、一定基準の下に、必要最小限の"Member registry"とそれ以外の"Associate registry"として束ね、これらの臨床試験登録システム内で一意となる試験識別番号をWHOが発行することにより、世界中に散在する臨床試験情報を統一的に検索できるようにすることを目指しています。現在のところ、"Member registry"は、WHOに一意な試験識別番号を申請することができる臨床試験登録システム、"Associate registry"は、"Member registry"と臨床試験情報を提供する関係を結んだものとされています。
2005年4月の会議以降、この制度の開始に向けてさらに検討が必要な部分について、登録システムの実務者レベルで継続的にメーリングリストを用いた討議が行われています。この討議における中心的な議題は、「登録する情報」と「WHO主導の世界的臨床試験登録制度に参加できる"Member registry"と"Associate registry"の基準」、「WHOへの試験識別番号の申請方法」です。
「登録する情報」については、上記に挙げた項目そのものは、ほぼ合意されていますが、知的所有権の保護の観点から、登録は行うが公開は留保してもよいとする項目に関する議論が続いています。議論の焦点は、いつ公開すべきか、という点です。
実務者レベルでの討議のほかにも、Scientific Advisory Group、International Advisory Boardと呼ばれる集まりにおいて、より上位レベルで必要な調整が行われています。この2つの集まりには、日本からも参加メンバーが任命されています。
